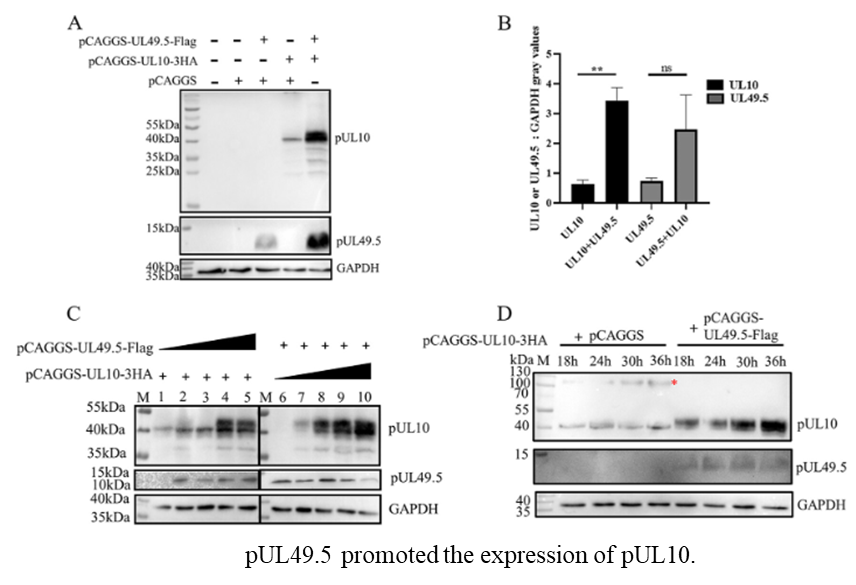
近日,美国微生物学会旗下生物学大类1区TOP期刊《Microbiology Spectrum》在线发表题为《N-Linked Glycosylation and Expression of Duck Plague Virus pUL10 Promoted by pUL49.5》的研究论文。文章的主要研究内容是确定了鸭瘟病毒中UL49.5蛋白与UL10蛋白存在相互作用及其互作方式是通过保守半胱氨酸形成二硫键,以及UL49.5促进UL10蛋白的N糖基化修饰、表达和定位改变。
鸭瘟病毒是高发病率、高病死率的急性烈性传染病,导致养鸭业经济严重受损。鸭瘟病毒感染宿主细胞的基础机制研究为未来防治鸭瘟疾病提供基础理论知识。鸭瘟病毒与宿主细胞膜首先接触的结构是病毒囊膜,其表面的囊膜蛋白在病毒感染宿主细胞的启动发挥至关重要的作用。UL10蛋白位于鸭瘟病毒囊膜表面,是整个疱疹病毒科中保守的蛋白之一。UL10蛋白在病毒融合、组装、细胞间传播、免疫逃避等过程中发挥着复杂的作用,与它的蛋白特性和伴侣蛋白密切相关。文章中作者确定了UL10的蛋白特征,如糖基化修饰的类型和亚细胞定位。且发现其他病毒蛋白参与了UL10蛋白的修饰和定位,而病毒UL49.5蛋白可与UL10通过二硫键形成复合物,且促进UL10蛋白定位到核周并发生了成熟的N糖基化修饰。
文章链接:https://doi.org/10.1128/spectrum.01625-23